研究テーマ概要
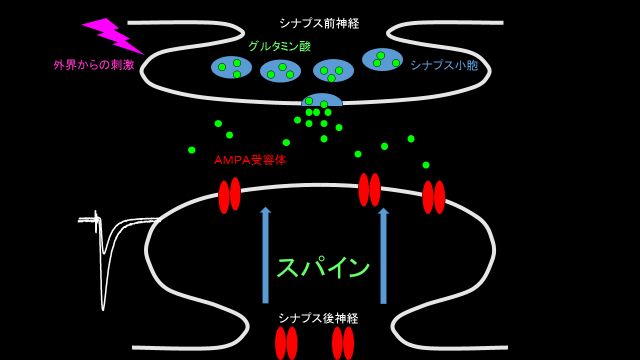
シナプスは神経細胞から別の神経細胞へ情報を伝達する構造体です。ある神経細胞に刺激が加わると、その神経にある「シナプス前末端」から神経伝達物質が放出され、受け手の神経細胞にある「シナプス後末端」に存在する受容体に結合し、情報伝達が行われます。外界からの入力により脳に変化が起こることを「可塑性」と呼びます。「可塑性」は記憶学習をはじめとして、我々が発育していく過程で様々な環境に順応し、能力を獲得していくための神経基盤と考えられています。グルタミン酸シナプスは興奮性シナプスの約9割を占めていると言われており、非常に重要な役割を果たしていることが明らかになっています。グルタミン酸受容体は数多く知られていますが、そのなかでもAMPA受容体は主役とも言える役割を果たしています。 げっ歯類における記憶学習の際に、脳内シナプスにおいてAMPA受容体がシナプスへ移行することは我々の研究室ですでに検証されています。我々の研究室では「AMPA 受容体シナプス移行」という切り口で可塑性をヒトにおいて観察、制御することにより臨床応用をめざしていくことを目指しています。
強固なシナプス基礎研究に裏付けされた臨床応用を目指して
現在、脳神経疾患(うつ病、統合失調症、薬物依存、癲癇、脳卒中等)の診断治療の現場は砂漠のような状態です。それは分子細胞レベルでの疾患の研究が進んでいないからです。一方、シナプス機能そのものの基礎研究はかなり成熟してきています。薬剤はすべて標的分子が存在します。したがって、分子細胞レベルでの強固な基礎研究の根拠に基づいた、診断法、治療法は上述の脳神経疾患には存在しないといっていいでしょう。我々は、脳神経疾患におけるこのような大きなギャップを埋め、基礎研究の論理的根拠がある革新的な診断治療法の開発を目指しています。
現在の研究
1. リハビリテーション効果促進薬の開発
現在、本邦の寝たきり患者の約4割の初発疾患が脳卒中であると言われています。我々は産学連携を通じて、AMPA受容体シナプス移行を促進する化合物の同定に成功し、リハビリテーション効果を劇的に促進させる作用があることを見出しました。今後は、サル、ヒトにおける効果を検証し、製品化を目指していきます。本薬剤は「可塑性作動薬」というこれまでにない新しい概念のものであり、革命的な効果を社会にもたらすと期待しています。同時に、そのメカニズムの基礎研究も行っていき、新たな創薬の礎を築いていきます。
- Hiroki Abe#, Susumu Jitsuki#, Waki Nakajima#, Yumi Murata#, Aoi Jitsuki-Takahashi, Yuki Katsuno, Hirobumi Tada, Akane Sano, Kumiko Suyama, Nobuyuki Mochizuki, Takashi Komori, Hitoshi Masuyama, Tomohiro Okuda, Yoshio Goshima, Noriyuki Higo, Takuya TAKAHASHI.
CRMP2-binding compound, edonerpic maleate, accelerates motor function recovery from brain damage.
Science 360; 50-57, 2018
2. AMPA受容体標識PET Probeの開発
我々はすでに、AMPA受容体を標識するPET Probeの開発に成功しております。現在、ヒトを用いたAMPA受容体の局在の検証を計画中です。この新規技術により、これまで臨床像でのみ診断がされてきた精神疾患(うつ病、人格障害、統合失調症、薬物依存、自閉症等)のシナプス機能分子を用いた新たな分類が可能になり、げっ歯類の研究では得られなかった新たな病態が見えてくることが期待されます。さらに、ヒトを用いた研究により同定された新たな疾患関連脳領域の分子細胞生物学的研究をげっ歯類に落とし込んで研究することにより、そのメカニズム解明、新規治療法への応用へとつなげていきます。本技術の開発により、精神神経疾患を「見て治す」という、他の多くの疾患においては普通に行われている診断治療のコンセプトを、脳神経疾患に応用することができます。例えば、AMPA受容体作動薬は世界中で開発されつつありますが、その臨床治験の成功率は決して高いとは言えません。むしろほとんどが失敗しているというのが現状です。しかしながら、本技術を用いて、AMPA受容体の発現量、分布に異常がある疾患をターゲットにしたAMPA受容体作動薬の臨床治験を行えば、その奏功率は劇的に上がり、これまでになかった効果の高い薬剤が患者さんのもとに届くことが期待されます。「AMPA受容体が下がっている疾患にはAMPA受容体の機能を上げる薬剤を、上がっている疾患にはAMPA受容体を下げる薬剤を投与する」という極めてシンプルな原理に基づいた革新的な診断治療のコンセプトを確立すれば、今後このような流れが主流になっていくと思われます。このように本技術がもたらす社会的影響は計り知れないものがあると期待しています。
- Miyazaki T, Nakajima W, Hatano M, Shibata Y, Kuroki Y, Arisawa T, Serizawa A, Sano A, Kogami SYamanoue T, Kimura K, Hirata Y, Takada Y, Ishiwata Y, Sonoda M, Tokunaga M, Seki C, Nagai Y,Minamimoto T, Kawamura K, M.R. Zhang, Ikegaya N, Iwasaki M, Kunii N,Kimura Y, Yamashita F, Taguri M, Mimura M, Yuzaki M, Kato H, Higuchi M, Uchida H, Takahashi T
Visualization of AMPA receptors in living human brain with positron emission tomography.
Nature Medicine. 26; 281-288, 2020 - Mai Hatano, Tomoyuki Miyazaki*, Yoshinobu Ishiwata, Waki Nakajima, Tetsu Arisawa, Yoko Kuroki, Ayako Kobayashi, YuukiTakada, Matsuyoshi Ogawa, Kazunori Kawamura, Ming‑Rong Zhang, Makoto Higuchi, MasatakaTaguri, Yasuyuki Kimura, Takuya Takahashi
Biodistribution and radiation dosimetry of the positron emission tomography probe for AMPA receptor, [11C]K‑2, in healthy human subjects
Scientifc Reports 11; 1598, 2021 - Tetsu Arisawa, Tomoyuki Miyazaki, Wataru Ota, Akane Sano, Kumiko Suyama, Yuuki Takada, Takuya Takahashi
[11C]K-2 image with positron emission tomography represents cell surface AMPA receptors
Neuroscience Research 173; 106-113, 2021 - Tetsu Arisawa, Kimito Kimura, Tomoyuki Miyazaki, Yuuki Takada, Waki Nakajima, Wataru Ota, Sadamitsu Ichijo, Akane Sano, Yuuka Hirao , Jun-Ichi Kurita, Yoshifumi Nishimura, Takuya Takahashi
Synthesis of [ 18 F] fluorine-labeled K-2 derivatives as radiotracers for AMPA receptors
Nuclear Medicine and Biology 110-111; 47-58, 2022
過去の主な成果
1. 経験依存的AMPA受容体シナプス移行の発見
我々はげっ歯類において世界ではじめて経験依存的にAMPA受容体シナプス移行が生体内で起こることを証明した。この実験系がその後のげっ歯類を用いたAMPA受容体シナプス移行の生体内評価系の礎となっている。
- Takahashi T., Svoboda K., Malinow R.
Experience strengthening transmission by driving AMPA receptors into synapses.
Science 299; 1585-1588, 2003
2. Cross-modal plasticityの分子細胞生物学
目が見えない人の体性感覚や聴覚が通常の人よりも優れていることは知られている。我々は視覚剥奪した動物の体性感覚野において、AMPA受容体シナプス移行がセロトニン分泌促進し、その結果体性感覚機能が向上することを示した。この研究は、「失われた機能を代償的に補う際に、残された脳領域にAMPA受容体のシナプス移行が起こり、機能的代償が成立する」という現在のリハビリテーション効果促進薬開発の源流となるコンセプトを確立した。
- Jitsuki S, Takemoto K, Kawasaki T, Tada T, Takahashi A, Becamel C, Sano A, Yuzaki M, Zukin RS, Ziff EB,Kessels HW,and Takahashi T.
Serotonin mediates cross-modal reorganization of cortical circuits.
Neuron 69, 780-792, 2011. - Nakajima W, Jitsuki S, Sano A, Takahashi T.
Sustained Enhancement of Lateral Inhibitory Circuit Maintains Cross Modal Cortical Reorganization.
PLoS One, 11(2):e0149068, 2016, Feb 10.
3. 社会的隔離動物におけるAMPA受容体シナプス移行不全
ネグレクトをはじめとした幼少期の虐待は大きな社会問題になっており、この経験を有する人は境界性人格障害等の重篤な精神疾患に罹患するケースが多い。我々は、ネグレクトにおいて見られる「社会的隔離環境」を経験したネズミにおいて、AMPA受容体シナプス移行が阻害されていることを見出した。この研究は、現在開発中のAMPA受容体を標識するPET(positron emission tomography) probeを用いてのヒト精神疾患の新規分類法の確立を目指した研究の基礎となるものである。
- Miyazaki T, Takase K, Nakajima W, Tada H, Ohya D, Sano A, Goto T, Hirase H, Malinow R, Takahashi T.
Disrupted cortical function Underlies behavior dysfunction due to social isolation.
Clin Invest.,122(7), 2690-701,2012. - Miyazaki T, Kunii S, Jitsuki S, Sano A, Kuroiwa Y, Takahashi T.
Social isolation perturbs experience-driven synaptic glutamate receptor subunit 4 delivery in the developing rat barrel cortex.
Eur J Neurosci., 37(10):1602-9, 2013. - Tada H,Miyazaki T,Takemoto K,Takase K,Jitsuki S,Nakajima W,Koide M,Yamamoto N,Komiya K, Suyamaa K,Sano A,Taguchi A,and Takahashi T.
Neonatal isolation augments social dominance by altering actin dynamics in the medialprefrontal cortex.
PNAS, E7097-E7105, 1606351113, 2016.10
4. 海馬依存的学習におけるAMPA受容体シナプス移行の役割
我々はげっ歯類を用いて、海馬依存的恐怖学習においてAMPA受容体がシナプスに移行していること、AMPA受容体シナプス移行が学習成立に必要であること、アセチルコリンがこれを仲介していることを見出した。この研究は現在進行中のAMPA受容体標識PET Probeの開発のスクリーニング系として利用されている。
- Mitsushima D, Ishihara K, Sano A, Kessels HW, Takahashi T.
Contaxtual learning requires synaptic AMPA receptor delivery in the hippocampus.
Proc Natl Acad Sci USA., 108(30),12503-12508, 2011. - Mitsushima D, Sano A, Takahashi T.
Cholinergic trigger drives learning-induced plasticity at hippocampal synapses.
Nature Communications, Vol 4, Article number 2760,2013. - Takemoto K,Iwanari H,Tada H,Suyama K,Sano A,Nagai T,Hamakubo T,and Takahashi T.
Optical inactivation of synaptic AMPA receptors erases fear memory.
Nature Biotechnology, 35(1);38-47, 2017 (*co-corresponding author)




